Equilibri Químic
1. Reaccions reversibles
i equilibri químic
Reaccions reversibles
Poden tenir lloc
en els dos sentits.
I si van a la mateixa
velocitat es que han
assolit l'estat d'equilibri.
3. Equilibri heterogeni
Equilibri homogeni
i heterogeni
Homogeni: totes les
espècies presents sun
a la mateixa fase.
Heterogeni: les espècies
químiques es troben en
fases diferents.
5. Energia lliure i k
Relació entre Gº i K

2. Kc i Kp
Kc

Kp

Qc
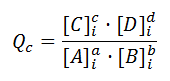
4. Principi de
Le Chatelier
Si un sistema en equilibri
rep una perturbación que modifica
qualsevol dels factors, la reacció
evolucionarà en el sentit que compensi
la modificación, retornan a l'estar d'equilibri
Factors que determinen
l'equilibri
Concentració
de r i p.
Pressió o volum
Temperatura
Addició d'un gas
inert
Catalitzador
6. Resolución de
problemes
Grau de dissociació
d'una substància